Конспект уроку: Багатоманітність речовин. Прості й складні речовини. Метали й неметали. Лабораторний дослід №1: Ознайомлення зі зразками простих і складних речовин
Навчальна мета: ввести поняття про різноманіття речовин; дати початкову класифікацію елементів на метали й неметали, їх поширення в природі; навчити розрізняти металічні й неметалічні елементи за їх положенням у періодичній системі; показати істотну відмінність фізичних і хімічних властивостей металів і неметалів.
Привітання вчителя й учнів. Перевірка присутніх. Перевірка готовності класу до уроку.
Назвіть період і групу, в якій знаходяться атоми:
С — II період, IV група, головна підгрупа;
А1 — III період, III група, головна підгрупа;
F — II період, VII група, головна підгрупа;
Fе — IV період, VIII група, побічна підгрупа;
Сu — IV період, І група, побічна підгрупа;
1) Обчисліть відносну атомну масу Нітрогену, Оксигену, Сульфуру, якщо атомні маси цих атомів відповідно дорівнюють: 2,33-10-26 кг; 2,66-10-26 кг; 5,32-10"26 кг.
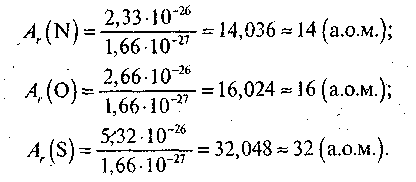
2) З допомогою періодичної системи визначте округлені значення відносної атомної маси таких елементів: Флуор, Натрій, Фосфор, Хлор (35,5), Аргентум, Аурум.
3) Ядро атома складається з протонів і нейтронів. Повернімося до таблиці з масами р, п, е-. Отже, m(р) = 1,66-10 - 27, тобто відносна маса протона дорівнює 1 а.о.м. ,
Аналогічною є відносна маса нейтрона — 1 а.о.м. А от електрон дуже маленький, його маса в 1840 разів менша за масу протона і нейтрона.
Тоді Аr = р + п. Відносна атомна маса дорівнює кількості протонів і нейтронів.
—Чому дорівнює кількість протонів у атомі? (Порядковому номеру)
—А як знайти кількість нейтронів у атомі? (n = Аr - р)
Наприклад: р = 3;п = 7 — 3 = 4.
4) Запишіть кількість протонів і нейтронів для Бору, Нітрогену, Флуору, Сульфуру.
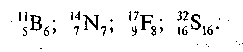
Повідомлення учням теми і мети уроку
Розгляньмо кристалічні ґратки.
Алмаз: у вузлах ґраток атоми Карбону С.
Вуглекислий газ: у вузлах ґраток молекули карбон (ІІ) оксиду С02.
Натрій хлорид: у вузлах ґраток йони — катіони Натрію Na+ та аніони ХлоруCl.
Отже, речовини можуть складатися як з окремих атомів, так і з молекул, або заряджених частинок — йонів.
Тому

Будова речовини залежить від природи хімічних елементів, що його утворюють.
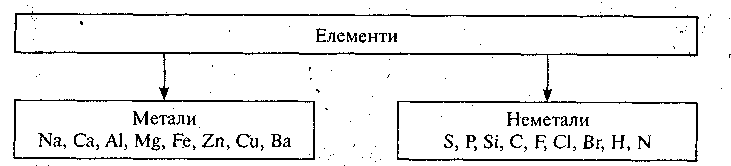
Перша класифікація хімічних елементів за властивостями передбачає їх поділ на метали й неметали.
Демонстрація 9. Розгляд зразків металів і неметалів.
Розгляньмо колекцію «Метали».
1. Які загальні властивості мають метали?
- Металевий блиск;
- сірі (крім міді); тверді;
- проводять електричний струм.
2. Розгляньмо зразки неметалів: сірка, графіт, ампула з кристалами I2. Додамо наші знання проN2 і O2
- Крихкі;
- тверді або газоподібні;
- різні властивості. Запишемо приклади:
Розгляньмо діаграму поширення елементів (урок 6).
1. Яких елементів у космосі більше — металів чи неметадів? (Неметалів — Н, Не)
2. Частка яких елементів більша в земній корі — металів чи неметалів? (Неметалів: 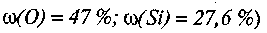
3. А які елементи містяться в повітрі? (Неметали Нітроген, Оксиген у складі речовин Н2, О2)
А тепер подивімося в періодичну систему. Умовна діагональ від Бору до Астату поділяє періодичну систему на дві частини: у нижній частині таблиці ліворуч від діагоналі знаходяться елементи-метали, а у верхній лівій частині знаходяться елементи-неметали (крім елементів побічних груп).
Відомі також елементи, що в сполуках виявляють властивості як металів, так і неметалів. Вони називаються перехідними елементами. До них належать, наприклад, Ре, Gе та інші.
Окрема група елементів — це елементи головної підгрупи VIII групи: Не, Ne, Аг, Кг, Хе, Rn. Їх називають інертними, або благородними, елементами, оскільки вони не виявляють ні властивостей металів, ні властивостей неметалів.
3. Робота в парах
Запропонуйте по п'ять прикладів елементів металів і неметалів з періодичної системи.
Обміняйтеся знаннями і перевірте з допомогою періодичної системи, чи правильно виконане завдання в сусідніх пар.
Демонстрація
Змішали порошок сірки і порошок заліза.
1. Як можна розділити цю суміш? (Залізо в суміші зберігає свої магнітні властивості, тому легко притягується магнітом) (Демонструємо, як залізо притягується до магніту.)
2. Чому залізо не можна вилучити з цієї ж суміші після нагрівання? (Залізо прореагувало із сіркою)
Запишемо рівняння:
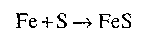
Тепер і залізо, і сірка змінили свої властивості. Відбулася хімічна реакція, з атомів Сульфуру і Феруму утворилася речовина складу FeS. Речовини до проведення досліду складалися з однакових атомів Sі Fе, після досліду речовина складається, з молекул FeS.
За якісним складом речовини поділяються на прості та складні.

Прості — речовини, молекули яких складаються з атомів одного хімічного елемента:
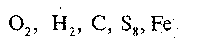
(Індекс унизу праворуч указує на число атомів у молекулі.)
Складні — речовини, молекули яких складаються з атомів двох і більше хімічних елементів.
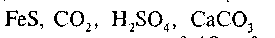
Вода — проста чи складна речовина? (Складна; складається з двох атомів Гідрогену й одного атома Оксигену — Н 2O)
Це можна довести шляхом розкладу води під дією електричного струму. Розгляньмо рисунок у підручнику, де зображено спеціальний прилад — електролізер, а рівняння реакції записується так:
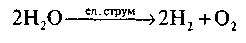
• На які дві групи поділяються хімічні елементи?
• Як розрізнити за положенням у періодичній системі металеві й неметалічні елементи?
• Чи можна за властивостями— хімічними чи фізичними— розрізнити, метал чи неметал?
Лабораторний дослід № 1
«Ознайомлення зі зразками простих і складних речовин»
В учнів на столі зразки:
простих речовин: сірка, залізо, вугілля, алюміній;
складних речовин: вода, натрій хлорид, купрум(ІІ) оксид, цукор.
1) Розгляньте речовини та відзначте:
агрегатний стан;
- колір;
- відношення до води;
- запах.
2) Зробіть висновок про фізичні властивості простих і складних речовин.
3) Ґрунтуючись на власному досвіді, запропонуйте можливі способи застосування цих речовин.
4) Чи можна за зовнішнім виглядом судити про приналежність речовини до простих чи складних речовин?
Учні записують у зошитах спостереження й оформляють їх у вигляді таблиці, окремо для простих і складних речовин.
прочитати параграф,
дати відповідь на запитання,
інше.



Коментарі ( 1 )
1
Залишити коментар