Конспект уроку: Ізопроцеси. Газові закони. Рівняння Мендєлєєва-Клапейрона
Навчальна мета: познайомитися з поняттям ізопроцесу; визначити газові закони; дати визначення рівнянню Мендєлєєва-Клапейрона.
Ізопроцеси
Будь-яка зміна стану тіла (або системи тіл) називається процесом. Оскільки стан газу визначається параметрами р, V й Т, то процес у газі спричиняє зміни цих параметрів.
Ізопроцесами називаються процеси, що відбуваються в системі зі незмінною масою при сталому значенні одного із параметрів р, V й Т. Ізопроцеси підкорюються газовим законам. Газові закони було відкрито дослідними методами задовго до створення молекулярно-кінетичної теорії.
Ізотермічний процес
Ізотермічний процес здійснюється в ідеальному газі при сталій температурі (Т = const) й описується законом Бойля-Маріотта: для даної маси газу при незмінній температурі добуток об’єму газу на тиск є величиною сталою:
Цей закон був вперше встановлений за результатами дослідів англійського фізика і хіміка Роберта Бойля у 1662 р. Незалежно від нього у 1676 р. французький фізик, один із засновників та перших членів Паризької Академії наук Едм Маріотт на підставі багатьох дослідів, здійснених при різних тисках, вивів закон про обернену пропорційність об'єму газу та тиску. Саме у працях Маріотта, зокрема трактаті „Дослід про природу повітря", закон Бойля-Маріотта одержав вичерпного тлумачення.
Графічна залежність між тиском й об’ємом для різних температур представляє собою рівнобічну гіперболу, яка називається ізотермою. Чим більша температура, при котрій відбувається процес, тим вище розміщується ізотерма у координатних осях р,V.
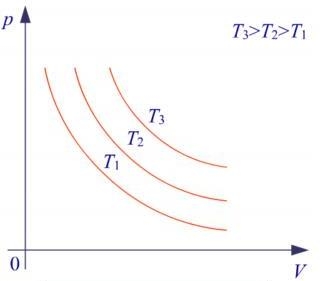
Рис. Графік ізотермічного процесу
Закон Бойля-Маріотта являється наближеним. При великих тисках і низьких температурах у реальних газів спостерігаються різкі відхилення від цього закону. Це пояснюється тим, що молекули речовини мають скінченний об’єм і взаємодіють між собою. Вперше ідею про неможливість використання закону Бойля-Маріотта до реальних газів висловив та обґрунтував Михайло Ломоносов, експериментально відхилення від закону досліджувались Дмитром Менделєєвим.
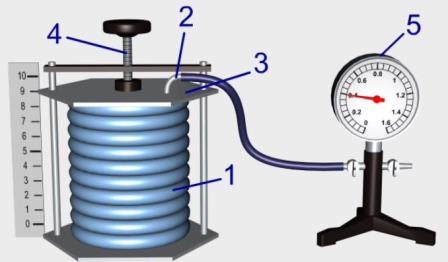
Рис. Прилад для вивчення газових законів
Для дослідної перевірки газових законів використовується спеціальний прилад. Основна частина приладу - закритий гофрований циліндр змінного обєму (сильфон) 1, який з’єднується із зовнішнім повітрям через патрубок 2, впаяний у металеву кришку 3. За допомогою гвинта 4 сильфон можна розтягувати або стискати, при цьому об’єм повітря у сильфоні змінюється пропорційно до зміни висоти сильфона. Об’єм газу вимірюється в умовних одиницях за шкалою, яка має 10 поділок. Показником при вимірюваннях об’єму є нижня поверхня кришки сильфона. Початковий об’єм сильфона 5, а кінцевий -10 умовних одиниць.
За допомогою гумової трубки сильфон з’єднується з демонстраційним манометром 5, межі вимірювання якого становлять від 0 до 1,6 атм. Ціна поділки манометра 0,05 атм, цифрові позначки нанесені через кожні 0,2 атм.
1 фізична атмосфера (атм) це позасистемна одиниця вимірювання тиску, її зв'язок з одиницею системи СІ має вигляд: 1 атм = 101325 Па.
Перевіримо закон Бойля-Маріотта на досліді.
На початку досліду з’єднаний за допомогою гумової трубки з манометром сильфон стиснено так, щоб об’єм повітря у ньому був 6 умовних одиниць. Бачимо, що тиск повітря в сильфоні -1,25 атм.
Збільшимо об’єм повітря у сильфоні до 8 умовних одиниць. Покази манометра при цьому - 0,94 атм.
При об’ємі повітря у сильфоні 9 умовних одиниць тиск дорівнює 0,83 атм.
Одержані результати дають можливість зробити висновок, що при незмінній масі газу та сталій температурі добуток об'єму газу на тиск є величиною сталою, тобто об'єм газу обернено пропорційний до тиску.
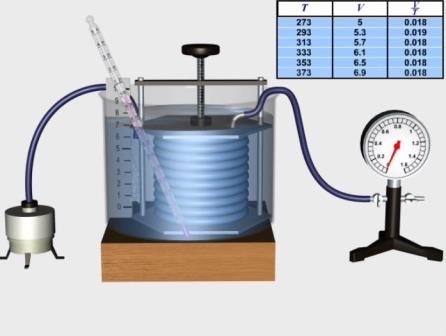
Рис. Перевірка закону Бойля-Маріотта
Ізобарний процес відбувається в ідеальному газі при сталому тиску (р = const). Для ізобарного процесу справедливий закон Гей-Люссака: при сталому тиску об’єм даної маси газу прямо пропорційний його абсолютній температурі:
Закон був відкритий в 1802 р. французьким фізиком та хіміком Луї Гей-Люссаком та незалежно від нього англійським вченим Джоном Дальтоном у 1807 р.
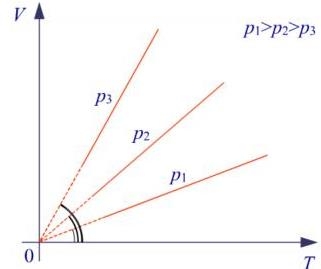
Рис. Графік ізобарного процесу.
Графік ізобарного процесу у координатних вісях V,Т зображається прямою, яка прямує до початку координат. Цю пряму називають ізобарою. Кут нахилу її до осі температур залежить від газового тиску: з підвищенням тиску кут нахилу зменшується. Ізобара не може бути проведена у області низьких температур, оскільки властивості газів при низьких температурах починають відхилятись від властивостей ідеальних газів.
Перевірка закону Гей-Люсака
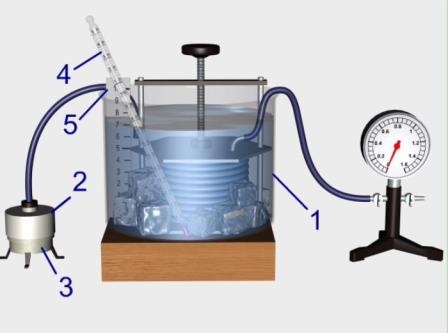
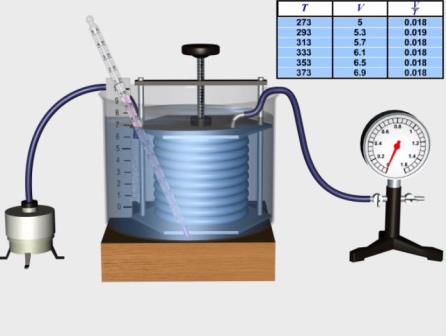
Рис. Перевірка закону Гей-Люсака
З метою перевірки експериментальної перевірки закону Гей-Люссака зберемо установку, як показано на рисунку. У цьому досліді додатково використовуються посудина з водою 1, пароутворювач лабораторний 2 з гумовою пробкою та гумовою трубкою, електрична плитка 3, рідинний термометр лабораторного типу 4. Сильфон з’єднаємо за допомогою гумової трубки з манометром та вмістимо в посудину із водою. У воду завчасно опустимо шматочки льоду, щоб температура повітря у циліндрі на початку досліду дорівнювала 0°С.
Етап 1.
Тиск повітря у циліндрі зручно взяти рівним атмосферному, для цього відкриємо обидва крани манометра. Початковий об’єм циліндра встановимо на позначці 5 умовних одиниць. Коли повітря у сильфоні охолодиться до 0°С, закриємо вільний кран манометра.
Етап 2.
Опустимо у посудину гумову трубку від пароутворювача і будемо пропускати через воду пару. Тиск повітря у циліндрі почне підвищуватись. За допомогою гвинта збільшуємо об’єм повітря так, щоб тиск весь час залишався сталим і дорівнював початковому. Перемішуючи воду у посудині, вимірюємо температуру через кожні 20°С.
Отже, при незмінній масі газу та сталому тиску відношення об'єму газу до його абсолютної температури величиною сталою, тобто об'єм газу прямо пропорційний абсолютній температурі.
Ізохорний процес
Ізохорний процес в ідеальному газі описується законом Шарля: при сталому об’ємі тиск маси газу прямо пропорційний його абсолютній температурі:
Цей закон був встановлений у 1787 р. французьким вченим та повітроплавцем Жаком Сезаром Шарлем.
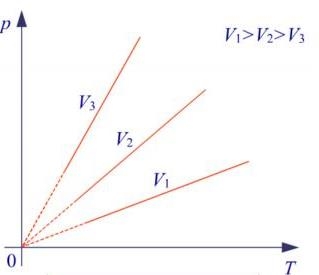
Рис. Графік ізохорного процесу
У координатних осях р,Т ізохорний процес зображається прямою лінією (ізохорою), яка прямує до початку координат. Вона ілюструє залежність тиску від температури для різних об'ємів однієї й тієї ж маси газу. Ізохору не можна продовжити в область низьких температур, де закони ідеальних газів не мають застосування, тому на рисунку їх продовжено умовно - пунктиром.
Для дослідного підтвердження закону Шарля скористаємось установкою, описаною у попередньому досліді.
Етап 1.
Встановимо об’єм сильфона на позначці 9 умовних одиниць та відкриємо обидва крани у манометра. Опустимо сильфон в посудину із водою і льодом.
Коли повітря у циліндрі охолодиться до 0°С, закриємо вільний кран манометра. При цьому тиск повітря в сильфоні дорівнює 1 атм.
Етап 2.
Опустимо у посудину гумову трубку пароутворювача і будемо пропускати через воду пару. Тиск повітря у циліндрі збільшується.
Результати експериментальної перевірки свідчать про те, що при незмінній масі газу й сталому об'ємі відношення тиску газу до його абсолютної температури являється величиною сталою, тобто тиск газу прямо пропорційний абсолютній температурі.
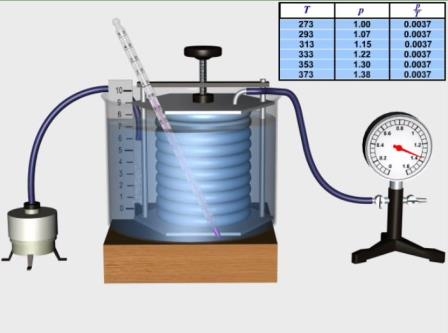
Рис. Перевірка закону Шарля
В 1834 р. французький фізик Поль Бенуа Клапейрон шляхом об'єднання законів Бойля-Маріотта та Гей-Люссака одержав рівняння, що встановлює взаємозв’язок між тиском, об’ємом й температурою газу:
Це рівняння одержало назву об'єднаного закону газового стану: добуток об’єму газу на його тиск прямо пропорційні абсолютній температурі газу.

Рис. Дослідження взаємозалежності між тиском, об'ємом й температурою
Зв’язок між тиском, об’ємом й температурою можна перевірити експериментально. Використаємо установку, описану у попередніх дослідах, але без пароутворювача.
Етап 1.
Закриємо вільний кран у манометра (він показує 1 атм), виміряємо об’єм повітря у сильфоні і температуру повітря, яка буде дорівнювати кімнатній (20°С).
Етап 2.
Після цього заповнимо посудину водою при температурі 60°С та довільно змінимо об’єм повітря у сильфоні за допомогою гвинта. Коли циліндр прогріється, виміряємо тиск, об’єм і температуру повітря.
Етап 3.
Замінимо гарячу воду у посудині на холодну. Знову довільно змінимо об’єм повітря у сильфоні та виміряємо тиск, об’єм і температуру повітря.
Порівняння значень pV/T показує, що залишаються вони майже незмінними, незважаючи на суттєві зміни відповідних параметрів стану повітря.
У 1874 р. Д. Менделєєв на базі молекулярно-кінетичних уявлень узагальнив об’єднаний закон газового стану у рівняння стану ідеального газу.
Виведемо це рівняння. Для цього в основне рівняння МКТ у вигляді 






Коментарі ( 1 )
Дякую за розробку
Залишити коментар