Конспект уроку: Властивості газів. Ідеальний газ. Тиск газу. Рівняння стану ідеального газу
Навчальна мета: познайомитися з властивостями газів; ознайомитися з поняттям ідеальний газ, навчитися визначати тиск газу; вивчити рівняння стану ідеального газу.
У молекулярно-кінетичній теорії розглядається ідеалізована модель реальних газів - ідеальний газ. Моделювання є особливим методом пізнання. Модель передає риси реального об'єкту і здатна замінити його на деяких етапах пізнання.
Молекулярна фізика повинна дати вичерпні відомості про природу газового стану речовини. Тому основні закономірності, які мають місце у реальному газі, досліджують на його моделі - ідеальному газі. У цій моделі зроблено певні припущення про властивості молекул газу та про особливості їх руху.
Ідеальним газом називається газ, між молекулами якого відсутні сили взаємного притягання. При цьому потенціальна енергія взаємодії молекул дорівнює нулю, повна енергія газу визначається сумою кінетичних енергій молекул, а взаємодія між молекулами відбувається за законами абсолютно пружного удару.
Реальний газ можна розглядати як ідеальний, якщо середня потенціальна енергія взаємодії молекул значно менша за їх середню кінетичну енергію. Це наближення застосовується до розріджених газів. Наприклад, гелій при нормальному тиску та кімнатній температурі можна вважати ідеальним газом.
Внаслідок хаотичності теплового руху молекул напрямки їх руху у тривимірному просторі є рівноймовірними: вздовж кожної з осей ОХ, ОY, 0Z рухається в середньому N/3 молекул. Враховуючи, що кожна вісь має два напрямки, у кожному з цих напрямків буде рухатись відповідно N/6 молекул.
Явища, які відбуваються з газами, визначаються у великій мірі швидкостями руху молекул. Швидкості газових молекул внаслідок їхнього хаотичного руху відрізняються між собою як за величиною, так й за власним напрямом. У молекулярно-кінетичній теорії газів користуються поняттями середньої арифметичної <v> та середньої квадратичної <vкв> швидкостей.
Середня арифметична швидкість визначається рівнянням:
де N - загальна кількість молекул.
Середня квадратична швидкість дорівнює сумі квадратів швидкостей усіх N молекул, поділеній на їх кількість:
Середню квадратичну швидкість називають ще тепловою. Значення (vкв) для газів досить великі. Так, для водню при кімнатній температурі <vкв> = 1,9-103 M/c, для азоту <vкв> = 493 M/c, для кисню <vкв> = 461 M/c.
Однією з основних величин, що характеризують стан газу і v безпосередньо вимірюються на досліді, є тиск р.
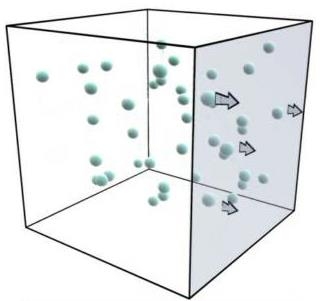
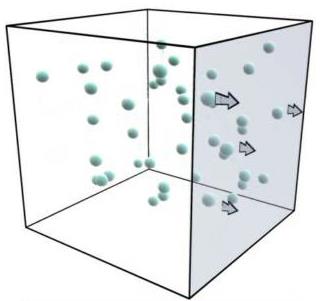
Рис. Механізм виникнення тиску в газах
Визначимо тиск газу на стінки посудини. Для цього з’ясуємо насамперед, чому дорівнює зміна імпульсу молекули з масою m0 і швидкістю руху v при пружному зіткненні зі стінкою.

Рис. Зміна імпульсу молекули
Будемо вважати, що ідеальний газ міститься у посудині кубічної форми. З ребрами куба пов’яжемо прямокутну систему координат O X Y Z. Знайдемо спочатку дію молекул на праву стінку посудиниплощиною S, перпендикулярну до вісі ОХ. При зіткненнях молекул з цією стінкою враховуватимемо лише зміни складових швидкостей у напрямі осі ОХ Оскільки значення vх у всіх молекул різні (внаслідок хаотичності їх руху), будемо користуватись середнім значенням швидкості молекул 
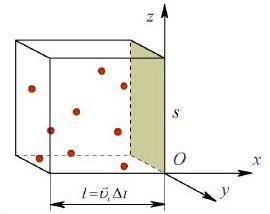
Як було з’ясовано вище, до кожної грані рухається N/6 молекул, де N - загальна кількість молекул у об’ємі посудини. Обчислимо сумарну зміну імпульсів всіх молекул за час ∆t Приймемо, що N/6 молекул пролітають відстань l, яка дорівнює ребру куба, за час ∆t
l = 

Тоді для сумарної зміни імпульсів молекул дістанемо:
Враховуючи, що загальна кількість молекул N може бути виражена через їх концентрацію n то об’єм посудини V (n = N/V), одержимо N = nV, де об’єм посудини V дорівнює добутку площі стінки S на ребро куба l:V =Sl== 
Отже,
Підставляючи вираз для N у рівність (1), дістанемо
Згідно другого закону Ньютона:
де F - сила, яка діє на молекули із сторони стінки.
За третім законом Ньютона така ж сила діє на стінку. Тоді, скоротивши у (2) час ∆t поділивши обидві частини цієї рівності на S, дістанемо вираз який описує тиск газу на праву стінку посудини:
Оскільки під час хаотичного руху молекул кожний напрям руху є рівноймовірним, то тиск газу на всі стінки посудини повинен бути однаковим: рх = ру = рz = р.
Остаточно маємо:
Рівняння (4) називають основним рівнянням молекулярно-кінетичної теорії газів. Встановлює рівняння зв’язок між мікроскопічними величинами, такими як маса та швидкість молекули, і макроскопічною величиною, такою як тиск, що характеризує газ як єдине ціле й безпосередньо вимірюється в досліді.
Основне рівняння молекулярно-кінетичної теорії газів записати можна у іншому вигляді. Помножимо й поділимо праву частину рівняння (4) на 2, дістанемо:
де Ек – це середня кінетична енергія поступального руху молекул. Таким чином, тиск ідеального газу дорівнює двум третинам середньої кінетичної енергії поступального руху молекул одиниці об’єму газу.
Основне рівняння молекулярно-кінетичної теорії газів встановлено з урахуванням лише зіткнень молекул із стінками посудини, при цьому їх зіткнення між собою в об’ємі газу не враховуються. Проте це не впливає на кінцевий результат, оскільки внутрішні зіткнення молекул змінюють лише модулі та напрями їх швидкостей, а результуюча швидкість молекул газу як системи практично не змінюється. Отже, спрощення уявлень про рух і взаємодію молекул дає можливість встановити основне рівняння молекулярно-кінетичної теорії газів.












Коментарі ( 0 )
Залишити коментар