Конспект уроку: Плавлення і кристалізація твердих та аморфних тіл
розкрити суть понять плавлення і кристалізація, визначити за яких умов відбування процес плавлення і кристалізації та яким тілам вони властиві; розвивати вміння розрізняти процеси плавлення і кристалізації
Плавлення
Процес переходу речовини з твердого стану в рідину називається плавленням.
 Для того, щоб розплавити тіло, необхідно для початку нагріти його до позначки певної температури. Температуру, за якої речовина плавиться, звуть температурою плавлення речовини.
Для того, щоб розплавити тіло, необхідно для початку нагріти його до позначки певної температури. Температуру, за якої речовина плавиться, звуть температурою плавлення речовини.
Між аморфними та кристалічними тілами при плавленні є відмінності. На відмінну від кристалічних тіл, у аморфних тіл немає певної сталої температури плавлення. Не мають сталої температури плавлення й тверднення, наприклад, віск, смола та ін. При наданні їм теплоти вони м’якшають, втрачають форму і течуть. До аморфних тіл за певних умов відносяться скло, гума (включаючи жувальну гумку), пластмаси.
Якщо кристалічному тілу надавати теплоту, то його температура поступово підвищуватиметься, а із досягненням температури плавлення тіло почне плавитися.
Одні тіла плавляться за низької температури, інші - за високої. За нормальних умов температура плавлення становить: для вольфраму 3387 °С, заліза 1535 °С, алюмінію 660 °С, нафталіну 80 °С, металу галію 29 °С (його можна плавити теплом людського тіла, тримаючи в руці).
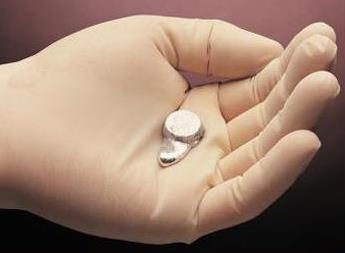
Рис. Плавлення галію
Графік плавлення й тверднення кристалічних тіл
Розглянемо процес плавлення кристалічного тіла. Для його аналізу побудуємо графік залежності температури кристалічного тіла (в даному випадку - льоду) від часу його нагрівання. По горизонтальній осі відкладатимемо час нагрівання, а по вертикальній - температуру у °С.
Для спостереження візьмемо певну кількість льоду при температурі - 40 °С (для нагрівання використано нагрівник постійної потужності). При нагріванні льоду до 0 °С його температура зросла від - 40 °С до 0 °С (ділянка АВ).
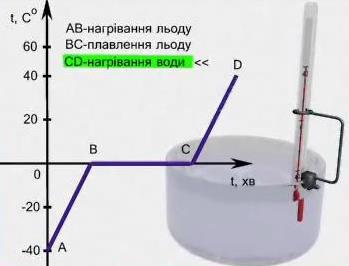
Рис. Графік плавлення льоду
Зростання температури відбувалось до 0 °С – температури плавлення льоду. При досягненні 0 °С лід почав плавитись, а температура суміші льоду і утвореної з нього води перестала рости, хоча нагрівання продовжувалось (ділянка на графіку ВС). Після того, як увесь лід розтанув, температура утвореної води почала зростати (ділянка CD).
Чим пояснити той факт, що під час плавлення кристалічного тіла його температура не зростає? На що витрачається теплова енергія, яка надається під час плавлення?
Як вам відомо, атоми у кристалічному тілі розташовані впорядковано і утворюють кристалічну решітку. Щоб її зруйнувати, необхідно надати тілу досить велику енергію. При цьому вже не залишається енергії для збільшення середньої кінетичної енергії атомів кристалічної речовини і її температура залишається постійною, поки кристалічна решітка не буде зруйнована, тобто поки вся речовина не розплавиться.
Розглянемо процес охолодження води та тверднення льоду.
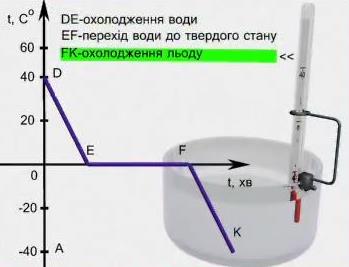
Рис. Процес твердіння води
Продовжимо розгляд графіка тепер вже на ділянках DЕ, ЕF, FК. Коли температура води досягла +40 °С (точка D) нагрівання води було припинено, вода стала остигати (ділянка БЕ). Коли температура води знизилась до 0 °С (точка Е) розпочався процес тверднення води; її кристалізація. Процес кристалізації відбувається, як видно, при сталій температурі, рівній температурі плавлення (ділянка ЕЖ) з виділенням речовиною теплоти, рівної теплоті плавлення. Як видно, поки вся вода не замерзла її температура не змінюється; лише після цього температура утвореного льоду починає знижуватись (ділянка FК).
Розгляньте сукупний графік
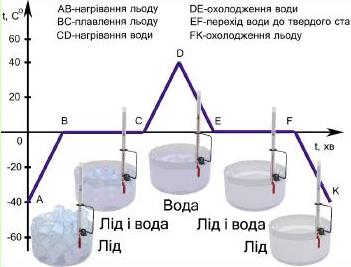
Рис. Графік: зміна температури води.
Якщо повторити цей самий дослід з аморфним тілом, наприклад, воском, то графік залежності температури від часу при нагріванні аморфного тіла буде зовсім іншим: різкого переходу від твердого стану до рідкого немає. В аморфних речовинах різкої перебудови їх структури немає, немає витрат енергії - вони поступово розм’якшуються при нагріванні та перехід від твердого стану до рідкого стає непомітним.
Порівняйте ці графіки, представлені у загальному вигляді.
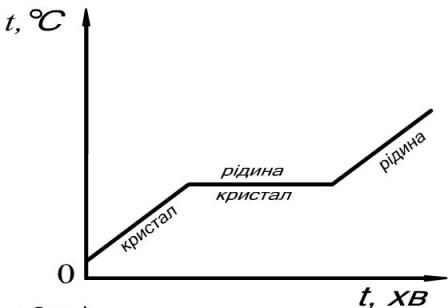
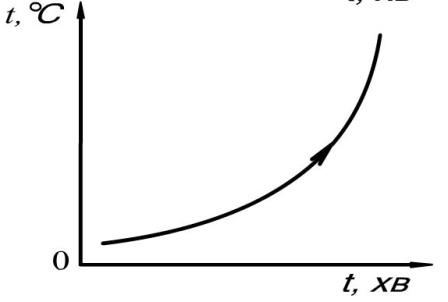
Рис. Плавлення тіл. Залежність температури від часу при нагріванні кристалічного (верхній графік) і аморфного (нижній графік) тіла.
Перевірка знань
1. Одна і та ж речовина може перебувати в різних агрегатних станах. Вкажіть, чи зміниться при переході із одного агрегатного стану у інший....:
І. ...її маса?
a) Так
b) Ні
II. ...її внутрішня енергія?
a) Так
b) Ні
III. ...її температура?
a) Так
b) Ні
IV. ...середня кінетична енергія молекул?
a) Так
b) Ні
V. ...потенціальна енергія взаємодії молекул?
a) Так
b) Ні
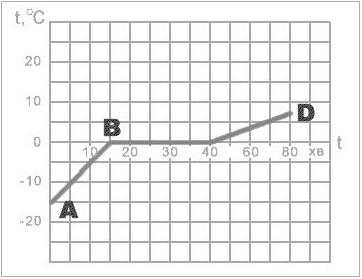
2. На малюнку зображено графік плавлення льоду. Вкажіть:
І. Якому стану відповідає відрізок АВ ?
a) Твердому
b) Рідкому
Газоподібному
II. Якому стану речовини відповідає відрізок ВС ?
a) Твердий
b) Рідкий
Газоподібний
III. Протягом якого часу відбувалося плавлення льоду ?
a) 45 хв
b) 25 хв
c) 80 хв
IV. На скільки градусів змінилась температура за час спостереження?
a) 15 °С
b) 7.5 °С
c) 22.5 °С



Коментарі ( 0 )
Залишити коментар