Конспект уроку: Взаємодія атомів та молекул речовин у різних агрегатних станах
Навчальна мета: познайомитись з взаємодією атомів й молекул в речовині в різних агрегатних станах;
Розвиваюча мета: навчитись визначати агрегатні стани та визначати умови переходу речовини з одного агрегатного стану в інший.
Між молекулами будь-якої речовини діють сили взаємного притягання та відштовхування, що підтверджується дослідними фактами.

Рис. Сили взаємодії між молекулами рідини. Процес капання з крану можна умовно поділити на 2 етапи - формування самої краплини внаслідок того, що між її молекулами краплин і молекулами поверхні, на якій вони знаходяться, діють сили притягання. Через деякий час частина великої краплини відривається і починає рухатись вниз, але сили взаємодії між молекулами у краплині утримують її від руйнування.
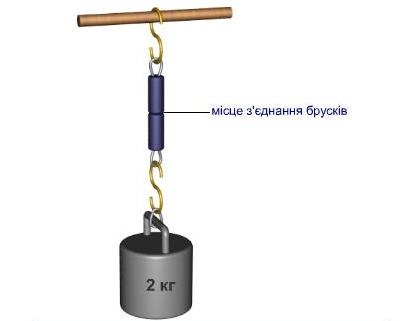
Рис. Сили взаємодії між молекулами твердого тіла. Притерті свіжими зрізами та стиснені свинцеві бруски з’єднуються за рахунок сил притягання між частинками так сильно, що можуть витримати значне навантаження.
З іншого боку, мала стискальність рідин та здатність твердих тіл чинити опір деформаціям підтверджують наявність сил відштовхування між частинками, з яких складаються тіла.
Сили міжмолекулярної взаємодії є короткодіючими і швидко зменшуються із збільшенням відстаней між молекулами.
На відстанях між центрами молекул порядку 10'9 м діють сили притягання, 10"10 м - сили відштовхування. Відстань між центрами і молекул, на якій сили притягання змінюються на сили відштовхування, приймається за діаметр молекули. Сили відштовхування зменшуються із збільшенням відстаней між центрами молекул швидше, ніж сили притягання. Слід відзначити, що сили притягання та відштовхування існують одночасно.
Розглянемо сили міжмолекулярної взаємодії в речовинах, які перебувають у різних агрегатних станах.
У газах сили притягання між молекулами не здатні утримати їх на певних відстанях, тому молекули розлітаються в різних напрямках внаслідок теплового руху і займають об'єм посудини, у якій вони знаходяться. Гази не мають певних об’єму і форми, а також легко стискаються під дією зовнішнього тиску.
У твердих тілах міжмолекулярний зв’язок досить сильний, тому частинки твердого тіла не можуть віддалятись на значні відстані. Тверді тіла мають кристалічну структуру, яка характеризується періодичністю у розташуванні частинок, тобто наявністю так званого дальнього порядку. Тепловий рух частинок у твердих тілах представляє собою хаотичні коливання частинок відносно їх положень рівноваги - вузлів кристалічної решітки. Характером міжмолекулярних сил зумовлені такі властивості твердих тіл як незмінність форми та об'єму.
Рідини мають певний об’єм, але не мають форми, важко стискаються. Це пов’язане з тим, що сильна міжмолекулярна взаємодія у рідинах забезпечує досить близьке розташування молекул рідини (10-10 м), але воно не є впорядкованим у всьому об’ємі. У рідинах спостерігається ближній порядок - повторюваність у розташуванні лише сусідніх частинок – який порушується вже при незначному збільшенні відстаней між молекулами. Тепловий рух молекул у рідинах характеризується тим, що протягом певного часу молекула здійснює хаотичні коливання біля положення рівноваги, після чого стрибком переміщується на відстань порядку 10-10 м.
Представимо взаємодію молекул схематично, вважаючи сили відштовхування - додатними, а сили притягання - від’ємними.
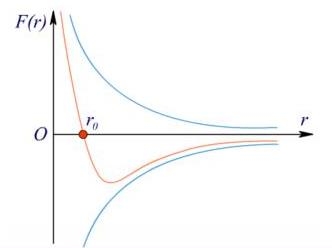
Рис. Графік залежності сили взаємодії молекул від відстані між ними



Коментарі ( 0 )
Залишити коментар