Конспект уроку: Застосування першого закону термодинаміки для ізопроцесів
закріпити знання щодо першого закону термодинаміки, визначити особливості застосування першого закону термодинаміки для різних ізопроцесів.
Ізотермічний процес
Ізотермічний процес (Т - const, ∆Т = Т2-Т1= 0).
Отже, в ізотермічному процесі зміна внутрішньої енергії ∆U = 0. Тоді із першого закону термодинаміки, слідує, що вся кількість теплоти передана системі дорівнює виконаній роботі над зовнішніми тілами:
Q = A = p(V2-V1).
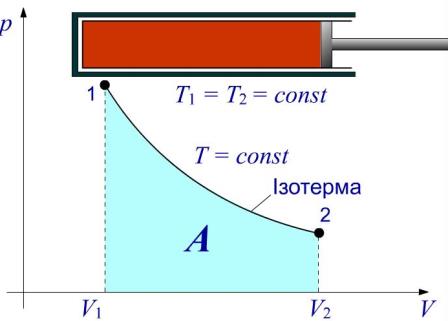
Рис. Робота у ізотермічному процесі
Система (в даному випадку це ідеальний газ у циліндрі під поршнем) при русі поршня переходить із стану 1 до стану 2 при постійній температурі Т = const. Виконана робота при розширенні газу вимірюється площею фігури під ізотермою 1-2.
Ізобарний процес
Ізобарний процес (р = const).
Перший закон термодинаміки для ізобарного процесу:
Q = ∆U + A,
або
Q = ∆U + p∆U.
Отже, при ізобарному процесі розширення газу, кількість теплоти переданої системі більша за виконану роботу на величину рівну зростанню внутрішньої енергії газу.
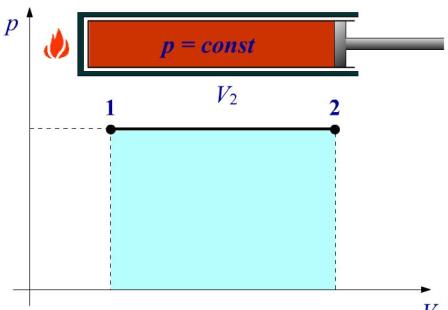
Рис. Робота в ізобарному процесі
Система (в даному випадку це ідеальний газ у циліндрі під поршнем) при русі поршня переходить із стану 1 до стану 2 при постійному тиску р = const. Виконана робота при розширенні газу вимірюється площею фігури під ізотермою 1-2.
Ізохорний процес
Ізохорний процес (V = const,V2 — V1 =0).
Перший закон термодинаміки для ізохорного процесу:
Q = ∆U
A = Р(V2-V1)=0.
При ізохорному процесі кількість теплоти, яку передано системі, йде на збільшення її внутрішньої енергії.
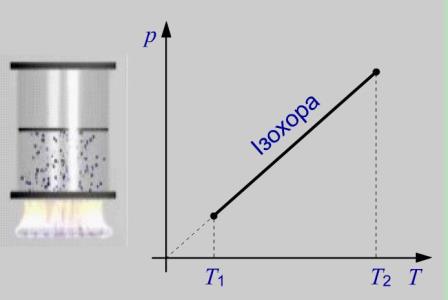
Рис. Робота в ізохорному процесі
Газ, який знаходиться під нерухомим поршнем (тобто об’єм газу є величина постійна V = const) отримує тепло від нагрівника. Зміна тиску газу прямо пропорційна зміні його температури.



Коментарі ( 0 )
Залишити коментар