Конспект уроку: Пароутворення і конденсація. Насичена і ненасичена пара
познайомити школярів з поняттями пароутворення і конденсація; спостерігати явище пароутворення; навчитися визначати насичену та ненасичену пару.
Пароутворення
В природі, техніці, побуті постійно відбуваються взаємні взаємоперетворення рідини та пари. Дані процеси мають важливе значення, особливо для води і водяної пари, оскільки водяна пара формується не лише над водоймищами, а й на суходолі, так як вода безперервно випаровується із поверхні ґрунту, з листя рослин, зі шкіри людей і тварин тощо.
Пароутворенням називається процес переходу речовини із рідкого стану в газоподібний. Сукупність молекул, котрі вилітають із рідини при пароутворенні, називається парою даної рідини. Мірою процесу пароутворення являється швидкість пароутворення - кількість рідини, яка переходить в пару за одиницю часу із одиниці площі поверхні взятої рідини.
Випаровування
Процес пароутворення, який відбувається при певній температурі із вільної поверхні рідини називають випаровуванням. В результаті випаровування над поверхнею кожної рідини знаходиться пара. Якщо процес пароутворення відбувається в замкненій посудині, то пара, що утворюється, не видаляється. За таких умов випаровування швидко припиниться і кількість рідини перестане зменшуватись, хоча молекули, здатні вилітати з поверхні рідини, будуть переходити у пару. У цьому випадку поряд з процесом випаровування відбувається зворотний процес конденсації - перетворення пари на рідину. Через деякий час у закритій посудині встановлюється так звана динамічна рівновага між процесами наступними пароутворення й конденсації: швидкість пароутворення стане рівною швидкості конденсації. Від цього моменту кількість рідини й її пари не буде змінюватись.
Насичена й ненасичена пара
Пара, що знаходиться в стані динамічної рівноваги із власною рідиною називають насиченою парою.
Очевидно, що ненасичена пара утворюється у тому випадку, коли кількість рідини є недостатньою для одержання насиченої пари.
Насичена пара не підкорюється газовим законам. Для ненасиченої пари газові закони виконуються наближено. Досліджуючи поведінку пари у просторі, з якого віддалені сторонні гази, можна одержати важливі відомості щодо властивостей пари. Наведемо приклад такого дослідження.
Вивчення властивостей насиченої пари
Етап 1.
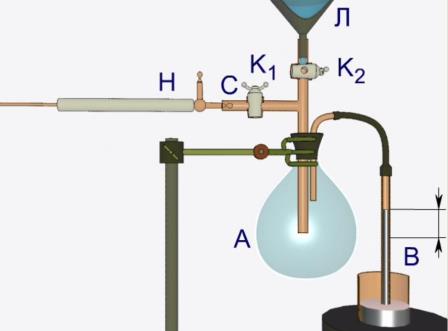
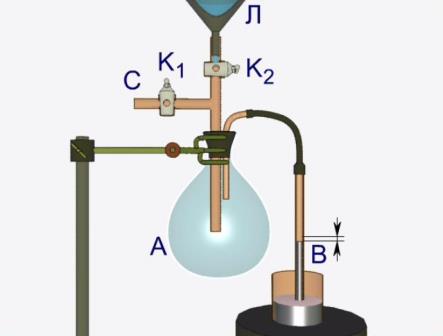
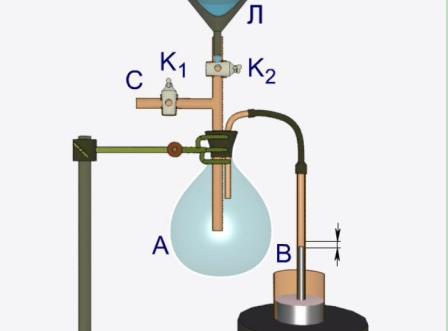
Колба А яка закрита гумовою пробкою, сполучена зі скляною трубкою В, зануреною у ртуть. Через трубку С, що забезпечена краном К1 з колби за допомогою ручного насосу Н відкачується повітря. При цьому ртуть у трубці В піднімається під дією атмосферного тиску.
Етап 2.
У лійку Л наливається ефір та обережно, по краплях, вводиться у колбу А за допомогою крану К2. Перші краплі ефіру миттєво випаровуються і ртуть у трубці В швидко опускається. За таких умов у колбі А утворюється ненасичена пара ефіру.
Етап 3.
Якщо у колбу А додати ще декілька порцій ефіру, то у колбі з’явиться рідина (оскільки частина ефіру не буде випаровуватись) і пара стане насиченою. Подальше збільшення кількості ефіру у колбі А не змінить положення ртуті у трубці В тиск насиченої пари рідини при незмінній температурі е величиною сталою.
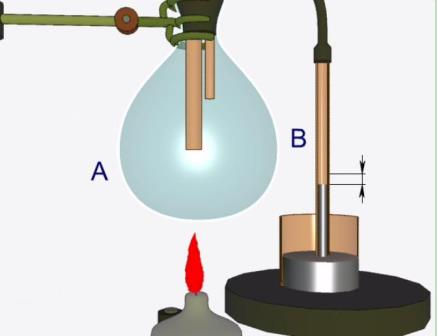
Етап 4.
Дослідимо інші властивості насиченої пари. За допомогою штатива підставимо під колбу А спиртівку. Внаслідок незначного нагрівання колби А спостерігається зниження рівня ртуті у трубці В Таким чином, можна впевнитися у тому, що тиск насиченої пари залежить від температури.
Результати виконання аналогічних дослідів з різними рідинами показують, що при однаковій температурі тиск насиченої пари в них значно відрізняється. Так, тиск насиченої пари ефіру при 20°С складає біля 440 мм рт. ст, а спирту - біля 44 мм рт. ст. Таким чином, тиск насиченої пари залежить від хімічного складу речовини.
Кипіння - це процес інтенсивного пароутворення не лише із вільної поверхні, але і у всьому об’ємі рідини всередину бульбашок пари, що при цьому утворюються.
Кипіння рідини починається при умові:
![]()
де pн - тиск насиченої пари всередині бульбашки, p0-зовнішній тиск.
Температурою (точкою) кипіння називається температура рідини, при якій тиск її насиченої пари дорівнює зовнішньому тиску або перебільшує його.
Отже, при збільшенні тиску на рідину температура її кипіння підвищується, а при зменшенні p0 знижується. Це випливає з умови кипіння: при збільшенні р0 зростає рн, необхідний для виникнення кипіння, що можливо лише при більш високій температурі. Залежність температури кипіння рідини від тиску можна продемонструвати на досліді.

Рис. Кипіння води під зниженим тиском
Етап 1.
Круглодонна скляна колба заповнюється на 1/3 підігрітою водою. Колба щільно закривається гумовою пробкою, через яку пропущено відрізок скляної трубки з натягнутим на неї гумовим шлангом. Колба закріплюється в лапці штатива і вода нагрівається до інтенсивного кипіння за допомогою спиртівки. При цьому тиск пари всередині колби дорівнює атмосферному, оскільки кипіння відбувається у відкритій колбі.
Етап 2.
Після закипання води спиртівка прибирається, а до гумового шлангу приєднується повітряний насос. Через 1-2 хвилини, коли вода трохи охолоне, з колби за допомогою насоса відкачується повітря й пари води. Тиск у колбі поступово зменшується і вода інтенсивно закипає. Отже, можна зробити висновок, що із зменшенням тиску температура кипіння рідини знижується.
Для процесу кипіння важливою умовою є також наявність центрів пароутворення (пилинок, бульбашок розчинених газів тощо). Якщо центри пароутворення у рідині відсутні, то її можна перегріти до температури, яка перебільшує точку кипіння при даному тиску. Перегріта рідина знаходиться у нестійкому (метастабільному) стані. Порушення такого стану викликає інтенсивне кипіння рідини.
Якщо зовнішній тиск р0 не змінюється, то у процесі кипіння температура рідини є сталою, незважаючи на безперервне підведення енергії ззовні. Отже, середні кінетичні енергії молекул киплячої рідини і її пари однакові, а енергія, яка підводиться, застосовується на поборення сил зчеплення між молекулами рідини та їх відривання від неї.
Кількість теплоти r, необхідна для перетворення в пару одиниці маси рідини при температурі її кипіння, називають питомою теплотою пароутворення.
Кількість теплоти Q, необхідну для перетворення в пару маси т рідини, можна обчислити за формулою
Q = rm.
З закону збереження енергії слідує, що при зворотному процесі - конденсації пари у рідину – виділяється кількість теплоти r.
Для різних рідин r значно відрізняється і залежить від сил молекулярного притягання.
З’ясуємо умови перетворення ненасиченої пари в насичену і навпаки. Для цього побудуємо ізотерму пари - криву залежності тиску пари р від його об'єму V.
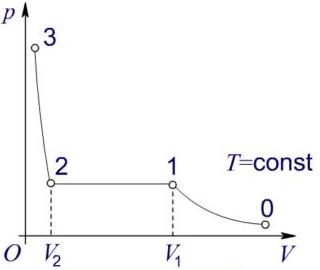
Рис. Ізотерми водяної пари
Етап 1.
При зменшенні об'єму ненасиченої пари на ділянці 0 —> 1 пара переходить у стан насичення в точці 1.
Етап 2.
При подальшому зменшенні об'єму на ділянці 1 —>2 тиск насиченої пари залишається незмінним; частина пари переходить у рідину і в точці 2 вся вона повністю конденсується.
Етап 3.
Зменшення об'єму рідини на ділянці 2 —> 3 вимагає значного збільшення тиску, оскільки рідина важко стискається. Отже, перетворення ненасиченої пари у насичену здійснюється шляхом ізотермічного стиснення, а насиченої пари в ненасичену шляхом ізотермічного розширення.
Слід відзначити, що перехід ненасиченої пари в насичену відбувається також при зниженні температури. Ненасичена пара при цьому частково перетворюється на рідину, що пояснює запотівання холодних предметів, внесених у теплу кімнату, утворення туману, роси тощо. Відповідно, перехід насиченої пари у ненасичену ] відбувається при підвищенні температури.
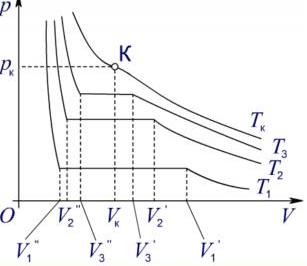
Рис. Ізотерми водяної пари для різних температур
Із підвищенням температури ділянка насиченої пари (горизонтальна ділянка ізотерми на ілюстрації) зменшується: при деякій температурі Tк насичена пара не утворюється. Це означає, що за певної критичної температури Тк, характерної для кожної речовини, стан речовини стає однорідним, тобто зникає відмінність між рідким і газоподібним станами. Горизонтальна ділянка ізотерми перетворюється при цьому на точку перегину К (критична точка). Це відбувається при певному тиску рк та об’ємі Vк, які разом з Tк називаються критичними параметрами. Стан речовини, який характеризується критичними параметрами, називається критичним станом.
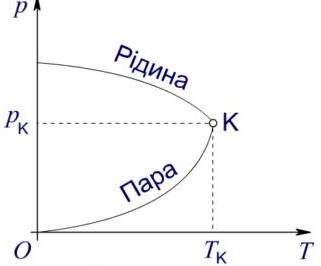
Рис. Критичний стан
Значення критичної температури можна також дістати, якщо побудувати криві залежності густин насиченої пари і рідини від температури.
Із збільшенням температури тиск насиченої пари та його густина швидко зростають.
Етап 2.
Густина рідини, яка знаходиться у стані динамічної рівноваги з своєю парою, при збільшенні температури зменшується за рахунок теплового розширення рідини.
Графіки залежності від температури густин насиченої пари і рідини перетинаються у критичній точці з температурою Тк. У критичній точці густина рідини рівна густині насиченої пари, яка знаходиться у стані рівноваги із рідиною.
Отже:
- при Т > ТК зникає відмінність між рідким та газоподібним станами речовини.
- при Т > Тк навіть при дуже великих тисках перетворення газу на рідину неможливо.



Коментарі ( 0 )
Залишити коментар