Конспект уроку: Кристалічні й аморфні тіла. Рідкі кристали та їх властивості. Полімери
ознайомити школярів з кристалічними і аморфними тілами; визначити поняття рідких кристалів та їх властивостей; розглянути полімери й їхнє використання людиною.
Кристалічні і аморфні тіла
Якщо за допомогою лупи розглянути сіль, цукор, соду, сніжинки, то можна побачити, що їх окремі частинки представляють собою тіла, обмежені плоскими гранями. Ці грані формують між собою певні кути, які у різних речовин є різними. Наявність таких граней свідчить, що речовина знаходиться у кристалічному стані. Тверді тіла, які мають впорядковане розташування у просторі своїх частинок, що періодично повторюється, називаються кристалами.
Інколи тіло представляє собою один кристал, в випадку, наприклад, із крупинкою цукрового піску. Такі тіла звуться монокристалами. Монокристали мають форму правильних багатогранників.
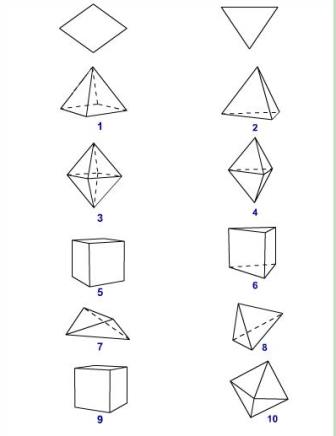
Рис. Форми кристалів: 1 - ромбічна піраміда, 2 - тригональна піраміда, 3 - ромбічна діпіраміда, 4 - тригональна діпіраміда, 5 - ромбічна призма, 6 - тригональна призма, 7 - ромбічний тетраедр, 8 - тетраедр, 9 - куб, 10 - октаедр.
Монокристали є анізотропними - їх фізичні властивості залежать від напрямку всередині кристалу.

Рис. Сніжинки. Сніжинки є полікристалами, тобто сукупністю великої кількості дрібних кристалів, що зрослися між собою.
У окремих випадках тіла є сукупністю значної кількості дрібних кристалів, що зрослися між собою. Такі тіла називаються полікристалами. Прикладами полікристалів можуть бути цукор-рафінад, шматок будь-якого металу, сніжинки. Полікристали через хаотичність орієнтацій монокристалів мають ізотропні (однакові у всіх напрямках) фізичні властивості.
Частинки, із яких складається кристал, утворюють в просторі правильну кристалічну (просторову) решітку. Основою кристалічної решітки є елементарна комірка певної геометричної форми, у вершинах якої – вузлах кристалічної решітки - розташовані частинки (атоми, молекули, іони).
Розрізняють кристали:
- іонні, коли у вузлах решітки знаходяться позитивно й негативно заряджені іони;
- атомні, коли у вузлах розміщені атоми, які утворюють з сусідніми атомами ковалентні зв’язки;
- молекулярні, коли у вузлах знаходяться нейтральні молекули, а зв’язок між ними здійснюється через дію міжмолекулярних сил;
- металічні, коли у вузлах розміщені позитивно заряджені іони металу, а зовнішні (валентні) електрони стають колективізованими і рухаються між іонами, утворюючи електронний газ.
Одною з найпростіших просторових граток іонного кристалу є гратка хлористого натрію HCl (кухонної солі), яка складається з іонів натрію і хлору. Кожний іон натрію оточують шість іонів хлору, розташованих в трьох взаємно перпендикулярних напрямках, а кожний іон хлору оточують шість іонів натрію.
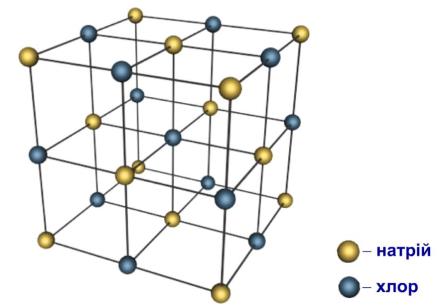
Рис. Кристалічна гратка кухонної солі
Плавлення твердих кристалічних речовин відбувається при певній температурі, яка називається температурою плавлення. При температурі плавлення речовина одночасно може існувати в твердому і рідкому станах.
Природне і штучне утворення кристалів
Утворення і ріст кристалів відбувається при переході речовини із газоподібного або рідкого стану у твердий, а також при розпаді твердих розчинів. Цей процес називається кристалізацією. У природі більшість кристалів, мінералів гірських порід утворились при охолодженні земної кори в різних геологічних епохах.
Багато мінералів виникли із перенасичених водних розчинів, наприклад, кам’яна сіль NаСІ. Товщина пластів солі кам’яної, які утворилися під час випаровування води із солоних озер, в деяких покладах досягає кількох сотень метрів.
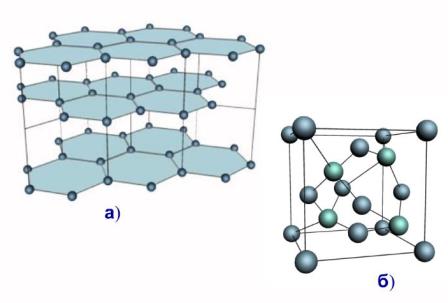
Рис. Кристалічні гратки графіту і алмазу.
Просторові гратки інших кристалів мають складнішу будову, ніж у хлористого натрію. В вузлах граток графіту (а) і алмазу (б) містяться атоми одного типу - атоми вуглецю.
Кристали можуть утворюватися не лише при замерзанні рідини, а й безпосередньо з пари. Прикладом цього є утворення інею та сніжинок з водяних парів повітря, а також кристаликів йоду з парів йоду.
Подібно до росту кристалів льоду відбувається ріст багатьох кристалів з розплавленого стану. З розплавів вирощуються монокристали корунду, рубіну, сапфіру.
Монокристали багатьох речовин (зокрема солей) можна вирощувати з розчинів (наприклад, випадання кристалів азотнокислого калію з його розчину у воді). Цим методом можна виростити монокристали різних розмірів: за декілька тижнів одержується монокристал сегнетової солі масою до 20 кг.
В останній час швидкими темпами розвиваються технології вирощування монокристалів на космічних орбітальних станціях. За умов невагомості і вакууму забезпечуються можливості одержання хімічно чистих кристалів.
У аморфних тіл (смоли, скло, пластмаси, віск) періодичність у розміщенні атомів відсутня, спостерігається лише часткова впорядкованість сусідніх атомів, тобто ближній порядок в розташуванні частинок. Аморфні тіла характеризуються ізотропними властивостями і не мають встановленої температури плавлення. Вони не плавляться, а розм’якшуються, поступово змінюючи свій стан, але весь час залишаються однорідними при збільшенні температури. З твердого стану аморфні тіла поступово переходять у м’який, а потім у стан густої рідини. Чим нижча температура, тим більше наближуються аморфні тіла за своїми властивостями до твердих тіл. Тому аморфний стан можна розглядати як переохолоджену рідину.
Різницю у будові кристалів і аморфних тіл зручно простежити на прикладі оксиду кремнію Si02 - речовини, яка може існувати як в кристалічному, так й у аморфному станах.
Кристали SiO2 - це кварц, який має правильну внутрішню структуру; у розміщенні частинок кварцу спостерігається дальній порядок.
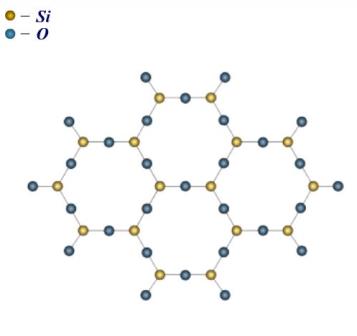
Рис. Будова кристалічного стану оксиду кремнію
Аморфний стан Si02 - кварцеве скло; його частинки з’єднані між собою по-різному, дальній порядок у їх розміщенні відсутній.
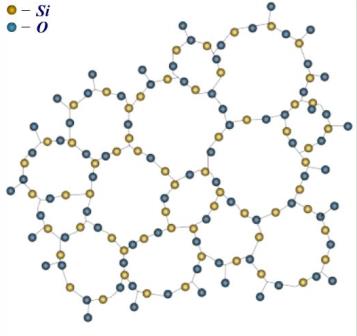
Рис. Будова аморфного стану оксиду кремнію
Рідкі кристали
У 1889 році були відкриті рідкі кристали. Це особливий стан окремих органічних речовин, у якому їм притаманні одночасно властивості кристалічного твердого тіла і рідини. Подібно до рідин кристали течуть, набувають форми посудини, у якій знаходяться, утворюють краплі. Подібно до кристалів у них спостерігається анізотропія всіх фізичних властивостей.
Рідкі кристали утворені з молекул, поздовжні розміри яких набагато більші за поперечні. Молекули орієнтовані вздовж певного напрямку і можуть бути різного типу. Розрізняють смектичні та нематичні рідкі кристали.
У смектичному рідкому кристалі молекули розташовані шарами. Прикладом смектичного рідкого кристалу являється розчин мила в воді: мильний розчин побудований із великої кількості подвійних шарів молекул мила, які розділені шарами води.
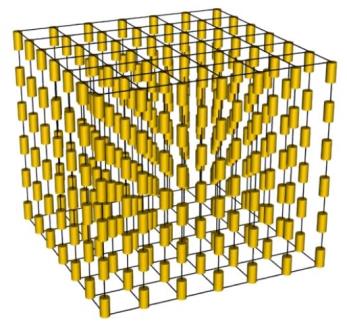
Рис. Будова смектичних рідких кристалів
В нематичному кристалі впорядкованість розташування молекул заключається у тому, що в певному об’ємі поздовжні осі усіх молекул паралельні, тобто спостерігається орієнтаційне впорядкування молекул уздовж певного напрямку.
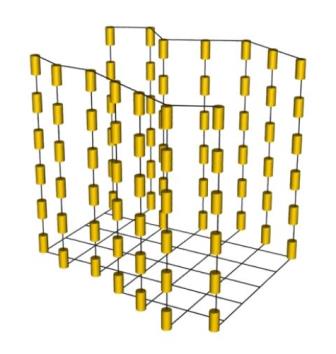
Рис. Будова нематичних рідких кристалів
Зараз відомо більше 3000 речовин, котрі утворюють рідкі кристали. До котрих належить велика кількість речовин органічного походження, зокрема дезоксирибонуклеїнова кислота та речовина мозку.
Рідкі кристали є надзвичайно чутливими до незначних зовнішніх змін, що зумовлює їх широке практичне застосування, особливо в системах обробки та відображення інформації (комп’ютери, ноутбуки, прилади для візуалізації деяких випромінювань). На основі рідких кристалів створюють прилади для визначення коливань температури, індикаторну техніку тощо.



Коментарі ( 0 )
Залишити коментар